南科大龚欣课题组报道真核生物神经酰胺合成酶的首个原子分辨率冷冻电镜结构
日期:2023-11-14
近日,南方科技大学生命科学学院副教授龚欣课题组在The EMBO Journal杂志在线发表了题为“Structure and mechanism of a eukaryotic ceramide synthase complex”的研究论文。该论文报道了真核生物神经酰胺合成酶的首个原子分辨率冷冻电镜结构,并揭示了其发挥功能的分子机制。
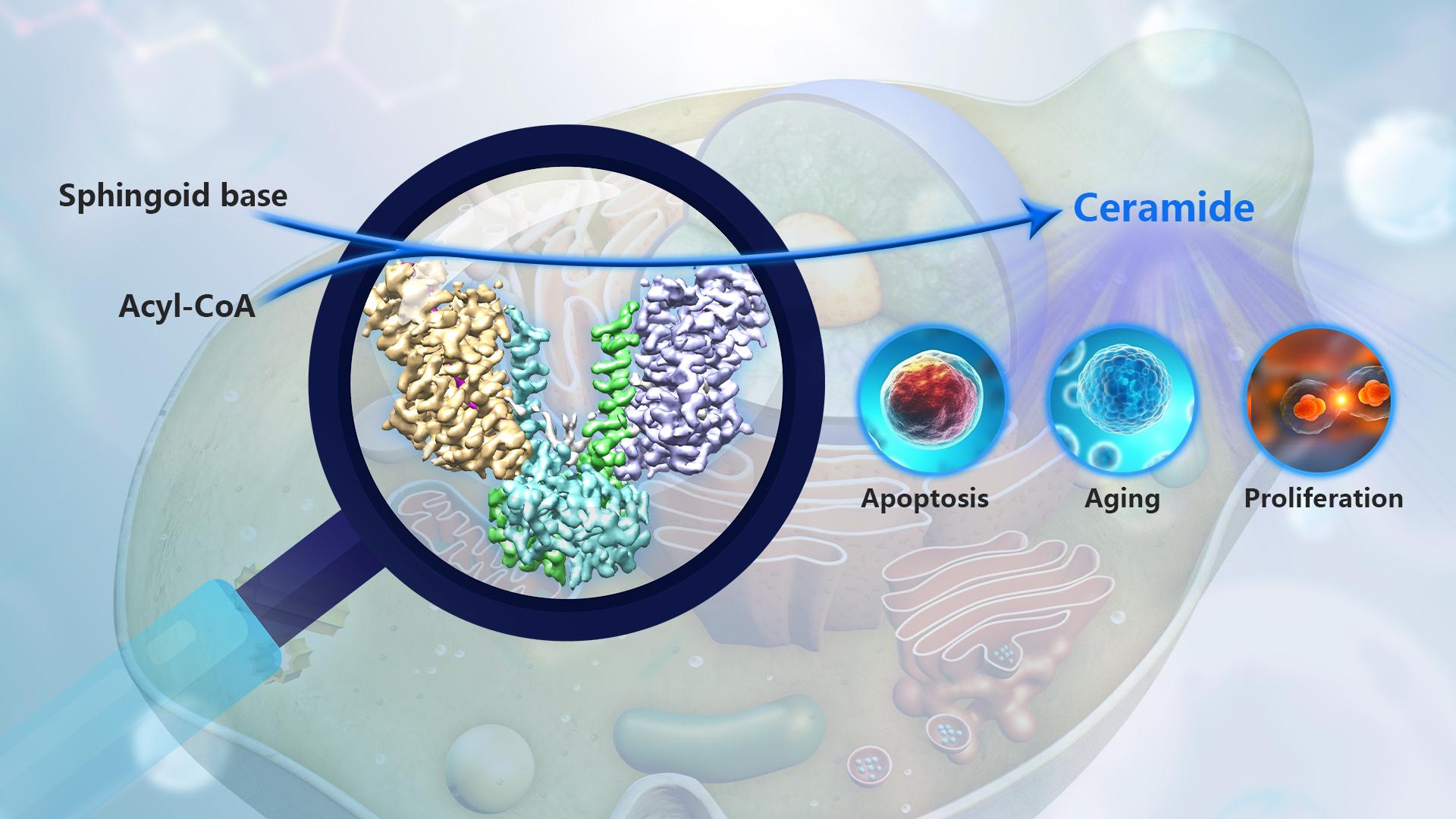
神经酰胺是真核生物鞘脂代谢的核心分子,同时也是关键的信号分子,参与调节许多细胞过程,如凋亡、衰老、增殖和分化等。神经酰胺的异常积累是许多人类代谢疾病的标志,如肥胖、糖尿病和心血管疾病等。神经酰胺的从头合成主要发生在内质网中,由神经酰胺合成酶(ceramide synthase, CerS)催化鞘氨醇与脂肪酰基辅酶A反应生成。神经酰胺合成酶被认为是肥胖、胰岛素抵抗、心血管疾病、非酒精性脂肪性肝、癌症等疾病的潜在治疗靶点。二十多年前,科学家在酿酒酵母中首次发现了神经酰胺合成酶,当时发现了两个被认为是冗余的基因编码的蛋白Lag1和Lac1参与了酰基辅酶A依赖的神经酰胺合成。后来的研究发现了一个新的调节亚基Lip1,它可以与Lag1或Lac1形成复合物。然而,Lip1调节亚基在神经酰胺合成反应中发挥功能的具体分子机理并不清楚。由于缺乏神经酰胺合成酶的结构信息,在很大程度上限制了对其功能的深入理解。
在本研究中,研究人员通过体外重组表达和纯化的方法获得了酿酒酵母神经酰胺合酶Lac1-Lip1复合物,并建立了体外生化实验来测定其催化活性。随后,利用单颗粒冷冻电镜技术解析了该复合物与底物C26-CoA结合的高分辨率三维结构(图1)。解析的结构显示,酵母神经酰胺合成酶在Lac1-Lip1二聚体复合物的基础上进一步通过Lip1二聚化形成了2:2形式的完整复合物。在每个Lac1-Lip1单体中,都能观察到一个C26-CoA分子位于Lac1亚基中。Lip1与Lac1通过广泛的相互作用,对于维持C26-CoA底物结合口袋非常重要,从而解释了调节亚基Lip1对于复合物的激活作用。
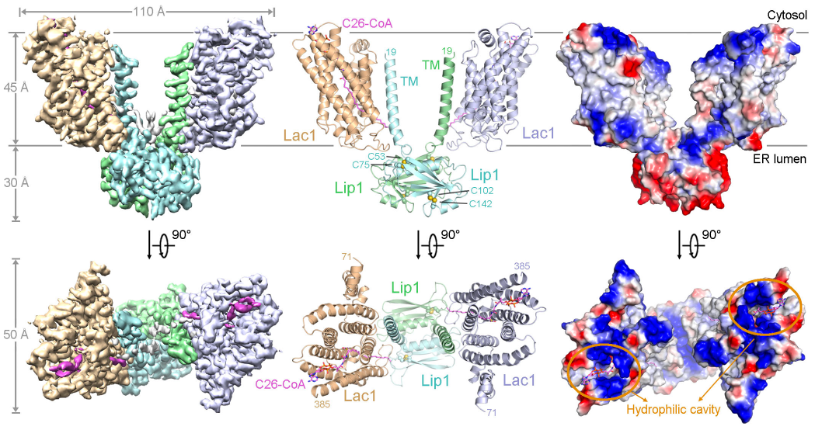
图1. 酵母Lac1-Lip1复合物与C26-CoA结合的整体结构
基于该研究中的结构生物学发现和结构指导的突变位点研究,研究人员提出了酵母神经酰胺合成酶催化神经酰胺合成的催化工作模型(图2)。在该模型中,C26-CoA底物从膜的胞质侧进入Lac1-Lip1二聚体的反应室,C26-CoA的CoA部分位于Lac1的亲水室中,而C26-CoA的酰基链与Lac1和Lip1共同形成的疏水通道结合。另一个底物鞘氨醇则可能通过Lac1上的一个侧向开口进入反应室。尽管仍有许多问题有待进一步研究,该研究的发现对理解真核生物神经酰胺合成酶的生物学功能具有重要意义,并有望促进未来用于治疗代谢性疾病和癌症的神经酰胺合成酶调节剂的合理设计。
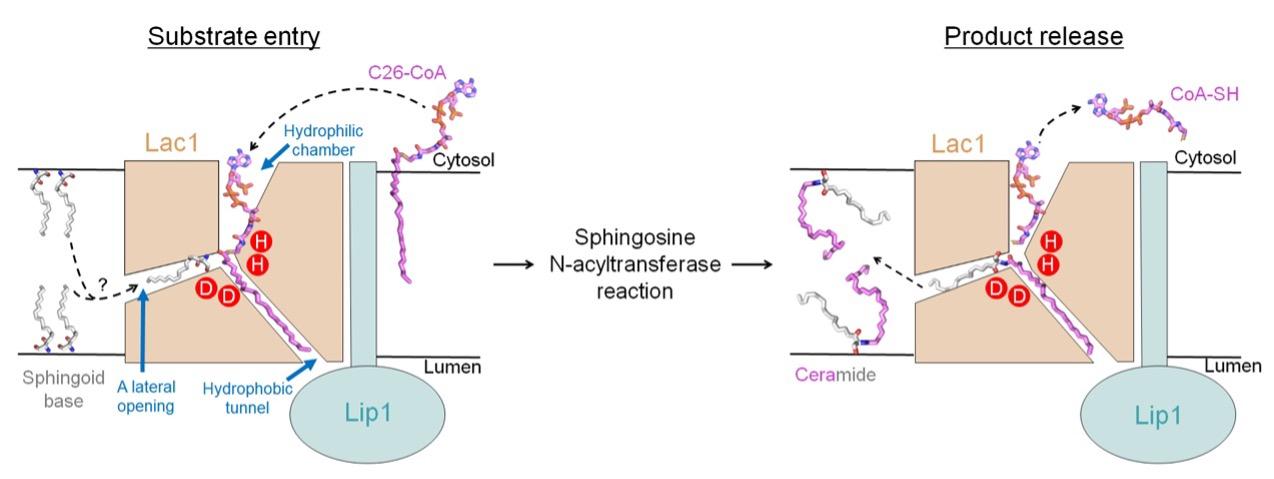
图2. 酵母神经酰胺合成酶的催化工作模型
该项研究的共同第一作者是南方科技大学生命科学学院研究副教授谢田和博士研究生方琪,通讯作者是龚欣,南科大是论文第一单位。该研究得到了国家自然科学基金、广东省科技厅和深圳市科创委的资助。冷冻电镜数据收集和处理均在南方科技大学冷冻电镜中心完成,并获得了中心的大力支持。
论文链接:https://doi.org/10.15252/embj.2023114889
供稿:生命科学学院
通讯员:付文卿
主图:丘妍
编辑:朱增光
最新动态
-
生命科学学院召开2024年度年会
Date:2024-12-17
-
南科大宋毅团队揭示植物塑造抗旱微生物组的遗传和生态学机制
Date:2024-12-10
-
南科大陈小菁课题组揭示海马空间认知功能的发育机制
Date:2024-12-04
-
我院开展“致敬胜利大营救,探寻生命新征程”攀登阳台山红色主题党日活动
Date:2024-12-02
